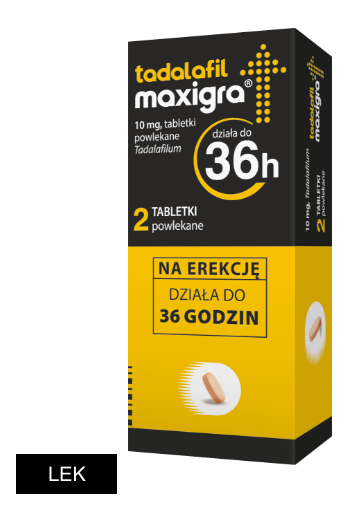
Tadalafil Maxigra, 2 tabl.
24,27 zł
To jest lek. Dla bezpieczeństwa stosuj go zgodnie z ulotką dołączoną do opakowania i tylko wtedy, gdy jest to konieczne. W przypadku wątpliwości skonsultuj się z lekarzem lub farmaceutą..
Produkt dostępny także w innych wariantach:
Inne produkty z kategorii :
13,48 zł
43,07 zł
25,39 zł
Tadalafil Maxigra, 2 tabl.
Wskazania:
Tadalafil Maxigra jest lekiem przeznaczonym dla dorosłych mężczyzn z zaburzeniami erekcji. Jest
to stan, kiedy mężczyzna nie może osiągnąć lub utrzymać wzwodu odpowiedniego do odbycia
stosunku płciowego. Wykazano, że lek Tadalafil Maxigra znacznie poprawia zdolność uzyskania
wzwodu odpowiedniego do odbycia stosunku płciowego.
Właściwości:
Tadalafil Maxigra zawiera substancję czynną tadalafil, który należy do grupy leków nazywanych
inhibitorami fosfodiesterazy typu 5. Po stymulacji seksualnej, Tadalafil Maxigra pomaga
w rozszerzeniu naczyń krwionośnych członka, co umożliwia napływ krwi do członka. W wyniku
tego dochodzi do poprawy erekcji.
Tadalafil Maxigra nie pomaga pacjentom, u których nie
występują zaburzenia erekcji.
Ważna jest świadomość, że lek Tadalafil Maxigra nie działa przy braku stymulacji seksualnej.
Istotne jest także zaaranżowanie gry wstępnej, tak samo jak w przypadku, gdy pacjent nie zażywa
leku na zaburzenia erekcji.
Składniki:
Tabletki powlekane. Każda tabletka zawiera 10 mg tadalafilu. Substancja pomocnicza o znanym działaniu: laktoza jednowodna. Każda tabletka powlekana zawiera 153,8 mg laktozy jednowodnej.
Stosowanie:
Zalecana dawka to jedna tabletka 10 mg, przyjmowana przed planowaną aktywnością seksualną.
Lek należy zażyć przynajmniej 30 minut przed planowaną aktywnością seksualną. Lek może być
skuteczny do 36 godzin po przyjęciu tabletki.
Lek do stosowania doraźnego, w miarę potrzeby.
Ważne informacje:
Nie przyjmować więcej niż 1 tabletkę. Leku nie stosować częściej niż 1 raz w tygodniu.
Opakowanie:
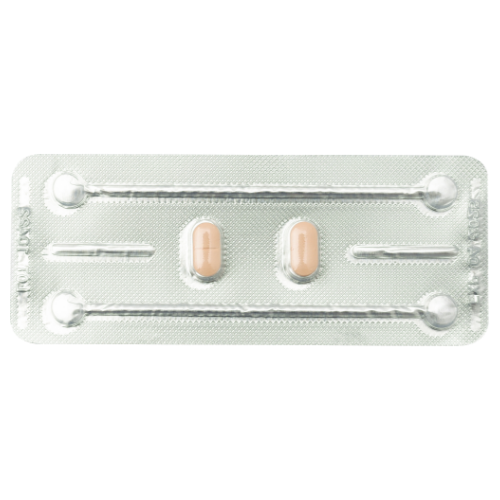
2 tabletki

2 tabletki powlekane

Tadalafil Maxigra® jest wskazana do stosowania u dorosłych mężczyzn z zaburzeniem erekcji, czyli niezdolnością uzyskania lub utrzymania erekcji prącia wystarczającej do odbycia stosunku płciowego.
W celu skutecznego działania produktu leczniczego Tadalafil Maxigra® niezbędna jest stymulacja seksualna.

Tadalafil Maxigra®
Każda tabletka zawiera 10 mg tadalafilu (Tadalafilum). Substancja pomocnicza o znanym działaniu: laktoza jednowodna.
Zalecana dawka to jedna tabletka 10 mg, przyjmowana przed planowaną aktywnością seksualną, niezależnie od posiłków. Produkt należy zażyć przynajmniej 30 minut przed planowaną aktywnością seksualną.
Produkt do stosowania doraźnego, w miarę potrzeby. Nie przyjmować więcej niż 1 tabletkę. Nie stosować częściej niż 1 raz w tygodniu.



1. 65% dorosłych Polaków w wieku 18‑70 lat zgadza się ze stwierdzeniem, że "lepszy sex to lepsze życie" (odpowiedzi top 2 boxes) na podstawie badania Omnibus przeprowadzonego przez agencję badawczą 4P, metoda CAWI, na próbie N=1051, w terminie 9‑11/12/2020.
2. Na podstawie ChPL Tadalafil Maxigra.
3. Evans JD, Hill SR. A comparison of the available phosphodiesterase‑5 inhibitors in the treatment of erectile dysfunction: a focus on avanafil. Patient Prefer Adherence. 2015 Aug 12;9:1159‑64
4. Pokarm nie wpływa na szybkość i stopień wchłaniania tadalafilu, dlatego produkt może być przyjmowany niezależnie od posiłków. Pora przyjmowania produktu (rano czy wieczorem) nie ma klinicznie istotnego wpływu na szybkość i stopień jego wchłaniania. Jednoczesne stosowanie tadalafilu (10 mg lub 20 mg) nie wpływało na stężenie alkoholu we krwi (średnie maksymalne stężenie we krwi 0,08%). Ponadto, nie obserwowano zmian w stężeniu tadalafilu w ciągu 3 godzin po podaniu go jednocześnie z alkoholem. Tadalafil (10 mg) nie nasilał wpływu alkoholu na funkcje poznawcze
Dotyczy leku Tadalafil Maxigra®:
Tadalafil Maxigra®. Skład i postać: Tabletki powlekane. Każda tabletka zawiera 10 mg tadalafilu. Substancja pomocnicza o znanym działaniu: laktoza jednowodna. Każda tabletka powlekana zawiera 153,8 mg laktozy jednowodnej. Wskazania: Leczenie zaburzeń erekcji u dorosłych mężczyzn. Aby tadalafil działał skutecznie, konieczna jest stymulacja seksualna. Produkt Tadalafil Maxigra nie jest przeznaczony do stosowania u kobiet. Podmiot odpowiedzialny: Zakłady Farmaceutyczne Polpharma S.A. Pozwolenie na dopuszczenie do obrotu nr 23996 wydane przez MZ. Lek wydawany bez recepty. ChPL: 2022.03.31.
*Dotyczy leku Maxigra® Go i Maxigra® MAX:
Maxigra Go.Skład i postać: Każda tabletka powlekana zawiera 25 mg syldenafilu w postaci syldenafilu cytrynianu. Wskazania: Produkt leczniczy Maxigra Go jest wskazany do stosowania u dorosłych mężczyzn z zaburzeniami erekcji, czyli niezdolnością uzyskania lub utrzymania erekcji prącia wystarczającej do odbycia stosunku płciowego. W celu skutecznego działania produktu leczniczego Maxigra Go niezbędna jest stymulacja seksualna. Podmiot odpowiedzialny: Zakłady Farmaceutyczne Polpharma S.A. Pozwolenie na dopuszczenie do obrotu nr 26546 wydane przez MZ ‑ dla tabletek powlekanych. Lek wydawany bez recepty.ChPL: 2021.07.23
Maxigra® Max (Sildenafilum). Skład i postać: 1 tabletka powlekana zawiera 50 mg syldenafilu w postaci syldenafilu cytrynianu. Wskazania: Produkt leczniczy Maxigra Max jest wskazany do stosowania u dorosłych mężczyzn z zaburzeniami erekcji, czyli niezdolnością uzyskania lub utrzymania erekcji prącia wystarczającej do odbycia stosunku płciowego. W celu skutecznego działania produktu leczniczego Maxigra Max niezbędna jest stymulacja seksualna. Pozwolenie na dopuszczenie do obrotu dla Maxigra Max 10309 wydane przez MZ. Lek wydawany bez recepty. ChPL: 2021.01.18. Podmiot odpowiedzialny: Zakłady Farmaceutyczne Polpharma S.A.
To jest lek. Dla bezpieczeństwa stosuj go zgodnie z ulotką dołączoną do opakowania. Nie przekraczaj maksymalnej dawki leku. W przypadku wątpliwości skonsultuj się z lekarzem lub farmaceutą.
Z tym produktem kupowano także:
27,59 zł
Cechy produktu
#73565
Substancje czynne:
Tadalafilum



























 Tadalafil -
Tadalafil - 






















